
Aggregatzustände
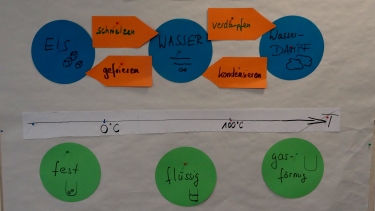
Aufgabe 1 Strukturlegemethode
Schreibe die Begriffe aus der "wordcloud" auf Metaplankarten und strukturiere sie.
Nutze hierfür verschiedene Farben und nach Möglichkeit Icons.
Welche Zusammenhänge kannst du zwischen den Begriffen herstellen?
Wenn die Struktur steht, erklärt immer einer einen Begriff und dreht diesen um.
Am Ende sollte jeder in der Lage sein, die Struktur blind in sein Heft zu übertragen.

Aufgabe 2 Praxisbeispiele

Finde Beispiele aus der Praxis in der Stoffe Ihre Aggregatzustände wechseln.
Zeichne jeweils eine Filmleiste.
Beschreibe zu jedem Bild in eigenen Worten den Prozess.
Welcher Prozess ist dir unklar?
Ideen:
Wasserkreislauf
Kühlschrank
Glasherstellung
Wärmepumpe
Aufgabe 3 Energiebedarf Wasser
Um den Aggregatzustand von Wasser zu ändern oder um dieses zu erwärmen, benötigt man Energie.
- Berechne die notwendige Energie um 4 l zu verdampfen.
- Berechne die notwendige Energie um 1 l Wasser von 20 °C zum Kochen zu bringen.
- Berechne die Wassermenge die du, mit der Verdampfungsungsernergie von 1 l Wasser, um 100 °C erwärmen kannst.
- Ergänze: "Wenn ich 1 kg Eis schmelze, kann ich mit der gleichen Energie 1 l Wasser um ... °C erwärmen."

- Verdampfungswärme: $E_{Wasserdampf}=4\cdot 2256000\:\text{J}=9024000\:\text{J}$
- notwendige Energie: $E_{80\:^\circ \text{C}}=80\cdot 4200 = 336000\:\text{J}$
Merke: Man benötigt in etwa die selbe Energiemenge um 1 l Wasser zum Kochen zu bringen oder 1 kg Eis zu schmelzen. - Verdampfungswärme: $E_{Wasserdampf}=2256000\:\text{J}$
Erwärmungsenergie: $E_{Wasser 100\:^\circ \text{C}} = 420000\:\text{J}$
Wassermenge: $m_{H2O}=\frac{2256000}{420000}\approx 5,371\:\text{kg}$ - Ergänze: "Wenn ich 1 kg Eis schmelze, kann ich mit der gleichen Energie 1 l Wasser um 79,52 °C erwärmen."
Aufgabe 4 spezifische Wärmekapazität
Die Fähigkeiten von Stoffen thermische Energie zu speichern ist in der Praxis oft bedeutsam. Beantworte hierzu folgende Fragen:
Wieso ist in Deutschland am Meer das größte Apfelanbaugebiet.
Mit was füllt man eine Wärmflasche und warum?
Wieso sind sonnenerwärmte Steine nach dem Sonnenuntergang noch warm?
Welche Energie benötigt man für Eis, Eisen und Wasser, um 100 kg um 40 °C zu erwärmen?
Ideen:
Das Meerwasser hat eine große Wärmekapazität, welche Frost in dessen Nähe verhindert.
Mit Wasser gefüllt bleibt die Wärmflasche am längsten warm.
Auch wenn Stein eine geringere Wärmekapazität hat, speichert er Wärme. Insbesondere durch die hohe Wärmeleitfähigkeit, wird eine hohe Masse an Stein erwärmt, die dann die Wärme auch wieder abstrahlt.
Eis (H2O): $\Delta Q = 2,06 \cdot 100 \cdot 40 = 8240$ kJ
Eisen (Fe): $\Delta Q = 0,45 \cdot 100 \cdot 40 = 1800$ kJ
Wasser (H2O): $\Delta Q = 4,18 \cdot 100 \cdot 40 = 16720$ kJ

Aufgabe 5 Kostenvergleich Heizungsart
Häuslesbauer in Deutschland benötigen eine Heizung. Dabei müssen sie zwischen verschiedenen Heizungsarten auswählen: Gasheizung, Ölheizung, Erdwärme, Holzheizung und elektrische Heizung.

Doch welche Heizungsart ist die günstigste? Beantworte dazu folgende Fragen:
- Nenne alle Faktoren die bei einer Laufzeit von 10 Jahren bei einer Kosten-Nutzenanalyse von Bedeutung sind.
- Erstelle eine Präsentation, bei der du die verschiedenen Heizungsarten quantitativ bei einer Laufzeit von 10 Jahren und einem jährlichen Wärmebedarf von 10.000.000 J vergleichst.
Hinweise:
1 J = 1 Ws und
1 kWh = 3600 Ws
Bei der Erdwärme wird aus 1 kWh Strom 4 kWh Wärme gewonnen.
Ideen:
- Faktoren: Bedarf, Energie-/Brennstoffkosten, ökologische Aspekte, Heizwert Hi in kJ/kg, Lieferkosten, Anschaffungskosten, Wartungskosten, Effizienz der Anlage
Wortliste und Satzbausteine
| der Gletscher, ~ | große Eismassen in den Bergen. |
| der Ozean, -e | das Meer |
| der Aggregatzustand, -"e | Die Zustände des Wasser: fest, gasförmig, flüssig. |
| der Körper, ~ | ein Gegenstand. |
| der Schmelzpunkt, -e | Temperatur bei der Eis flüssig wird. |
| der Siedepunkt, -e | Temperatur bei der Wasser gasförmig wird. |
| flüssig | ein nasser Aggregatzustand |
| gasförmig | ein unsichtbarer Aggregatzustand |
| fest | ein trockener Aggregatzustand |
| kondensieren | Übergang von gasförmig zu flüssig |
| erstarren | Übergang von flüssig zu fest (auch: gefrieren) |





